Vacunas pediátricas: hay 150 mil chicos con comorbilidades menores de 18 años
La Casa Rosada anunció que el próximo lunes firmará el trato con el laboratorio norteamericano. Esperan que la FDA apruebe pronto su uso pediátrico. Expectativas por el análisis de la documentación del suero chino en la ANMAT.
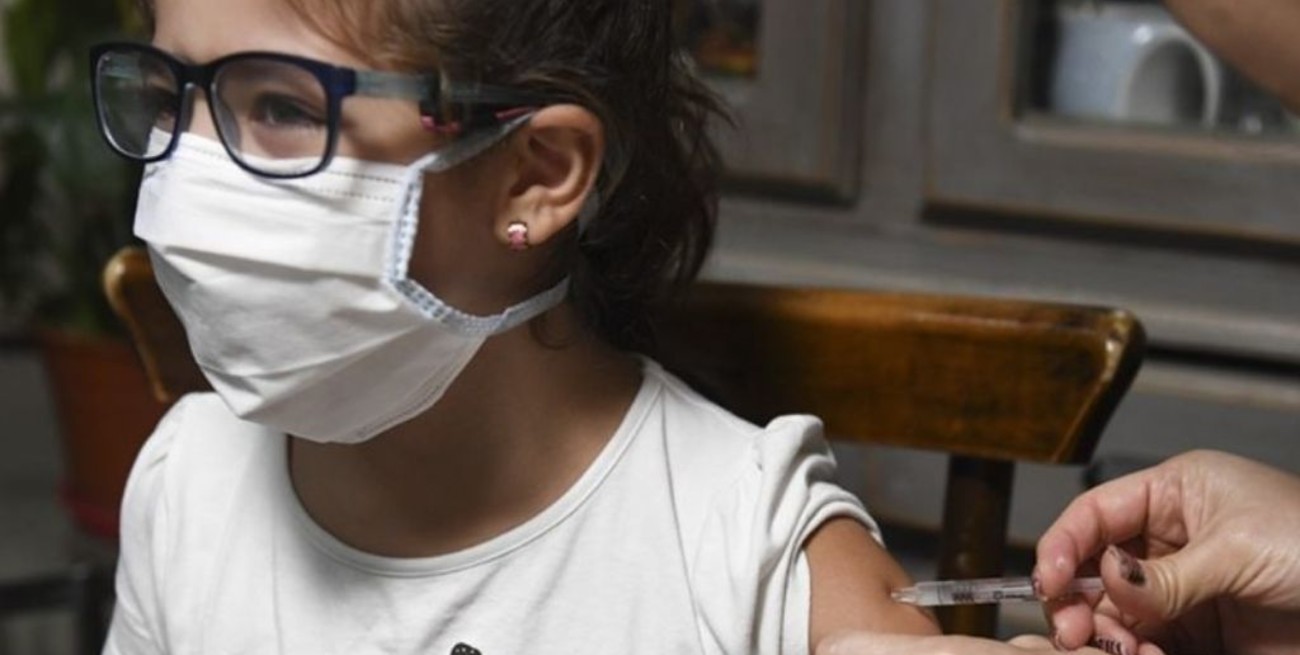
Sobre el escritorio de una funcionaria del Ministerio de Salud de la Nación hay un papel con un número que, lejos de ser solo una cifra, representa el total de menores de edad con comorbilidades que esperan recibir una vacuna contra el coronavirus pero que no pueden inmunizarse debido a que la Argentina aún no posee sueros autorizados para su utilización en este rango etario.
En este sentido en la cartera de Salud barajan tres grandes grupos de posibilidades para comenzar a dar respuesta a los miles de padres que exigen que sus hijos sean inoculados: cerrar el trato con Pfizer, cuyas dosis están autorizadas para ser utilizadas en este grupo etario, avanzar en el trato con Moderna (que se firmará el lunes), un suero que está a punto de ser autorizada por la FDA para su utilización en jóvenes que tengan menos de 18 años y que la ANMAT reciba la documentación del laboratorio chino estatal Sinopharm sobre sus pruebas en menores, las que -en la cartera de Salud aseguran- dieron muy buenos resultados en Emiratos Árabes y China.
Por estas horas las autoridades del Ministerio de Salud de la Nación intentar cerrar los tratos con Pfizer y Moderna. “El marco legal ya está, ahora restan detalles vinculados a la cantidad de dosis, precio y cronograma de entrega”, dijeron fuentes de esa cartera. Aún no hay una fecha precisa sobre cuándo podría ocurrir, pero el anuncio sería inminente. “Somos optimistas de poder cerrar con ambas firmas para además poder recibir las donaciones de los Estados Unidos”, agregan.
A su vez, este jueves el jefe de Gabinete Santiago Cafiero confirmó que el próximo lunes se firmará un contrato con Moderna por su vacuna contra el COVID-19. Es un suero con una tecnología de avanzada que genera expectativas en el Gobierno. El último encuentro formal entre las partes ocurrió el 30 de junio, cuando el secretario de Gestión Administrativa del Ministerio de Salud Mauricio Monsalvo mantuvo una audiencia virtual con Román Eduardo Saglio, directivo del laboratorio. Del encuentro también formaron parte representantes del Banco Mundial que entregarían un crédito para la adquisición de las dosis.
La semana pasada el Gobierno firmó un DNU a través del que quitó la palabra “negligencia” de la Ley de Vacunas sancionada en noviembre de 2020 para otorgarle un marco legal adecuado al posible acuerdo con Pfizer, Moderna y Johnson & Johnson.

La secretaria de Legal y Técnica Vilma Ibarra confirmó ante el Congreso que el Gobierno decidió cambiar la normativa luego de que la vacuna de Pfizer fuese aprobada para uso pediátrico. “Es algo que nos resulta prioritario, rápido y necesario”, señaló. Y agregó: “Es el producto de una larga negociación, hay gente que pregunta por qué no se hizo antes. Esto no es ir a la esquina a comprar un paquete de galletitas, son laboratorios internacionales, con casas matrices, hemos hecho un enorme trabajo técnico y jurídico para poder acercar posiciones que estaban muy lejos”.
Además de eliminar la causal de “negligencia” como atributo de responsabilidad del proveedor, el DNU reemplaza los términos “maniobras fraudulentas y conductas maliciosas” por “conductas dolosas”, concepto incluido en el artículo 1724 del Código Civil y Comercial de la Nación. A su vez se anunció la creación del “Fondo de Reparación Covid-19” para responder al pago de indemnizaciones ante la eventualidad de que alguna persona pueda ser dañada por la aplicación de una vacuna.
El último gran escenario de posibilidad para comenzar a vacunar a los menores de edad proviene de China. Es que el laboratorio estatal Sinopharm ya inició las pruebas en menores de edad en ese país y los Emiratos Árabes, con “muy buenos resultados” dijeron desde Salud. Sin embargo, para que la Argentina pueda comenzar a utilizar ese suero en los jóvenes, es necesario que la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) reciba la documentación pertinente, lo que al momento no ocurrió. “Somos optimistas, también hubo retrasos cuando debíamos tener la información respecto a los mayores de 60″, aseguran.











