Argentina tendrá en los próximos días su tercera vacuna contra el coronavirus. A la Sputnik V y Covishield, que ya se aplican en el país, se sumará el fármaco Sinopharm, de origen chino, que demostró meses atrás una efectividad del 86%.
Las diferencias entre Sputnik V, Covishield y Sinopharm, las tres vacunas que tendrá la Argentina
Luego del escándalo desatado por el “Vacunatorio VIP”, parte de la estrategia gubernamental pasa por intensificar el control de la aplicación de las dosis disponibles y que se transparente el accionar.
También presenta una “tasa del 99% de seroconversión de anticuerpos neutralizantes y 100% de efectividad en la prevención de casos moderados y severos de la enfermedad”, según estudios científicos.
Según confirmó el Gobierno, un avión de Aerolíneas Argentinas despegó este martes rumbo a Beijing, China, para buscar un cargamento de alrededor de un millón de dosis.

El regreso del vuelo AR1050 está previsto para el jueves 25 e inmediatamente el embarque se destinará a la intensificación del plan de vacunación oficial que ya lleva 720.267 personas inoculadas al 21 de febrero según datos que publica el rastreador estadístico Our World In Data, que sitúa a nuestro país decimonoveno entre las veinte naciones que más vacunaron en todo el globo.
Luego del escándalo desatado por el “Vacunatorio VIP” que funcionó en el Hospital Posadas de Haedo y en el Ministerio de Salud, que le costó el despido al ministro Ginés González García, la nueva ministra Carla Vizzotti aprobó la vacuna china el domingo pasado tras las sugerencias de la ANMAT.
Ahora, parte de la estrategia gubernamental pasa por intensificar el control de la aplicación de las dosis disponibles y que se transparente el accionar. Por eso esta semana también se espera la llegada de otras 300 mil dosis de la vacuna rusa, Sputnik V.
A continuación, las diferencias entre las tres vacunas
Sinopharm
La vacuna desarrollada por Sinopharm en colaboración con el Laboratorio Beijing Institute of Biological Products de China es una vacuna “inactivada”, lo que significa que porta una versión del virus alterada genéticamente que le impide reproducirse y desarrollar la enfermedad, pero que genera una “respuesta inmune en el organismo con capacidad protectora”.
Contiene una versión muerta del germen que no produce enfermedad pero genera anticuerpos y que ya se utiliza en varias vacunas como las de la gripe, hepatitis A, polio y la rabia. Es la primera vacuna en utilizar un inmunógeno proteico.
Ese lote nuevo de vacunas se sumará a las remesas ya recibidas desde finales de diciembre: 1,22 millones de dosis de la Sputnik V y 580.000 del Instituto Serum de la India, realizada con la tecnología de la británica AstraZeneca.
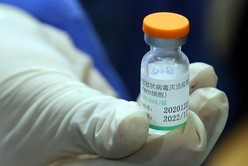
La vacuna requiere de dos dosis que se han de aplicar con al menos 21 días de diferencia, y puede transportarse y almacenarse a entre 2 ºC y 8 °C y permanecer estable durante 24 meses. “Los ensayos clínicos de Fase I y II, publicados en la revista médica The Lancet, demostraron que esta vacuna es segura y eficaz. Los ensayos de Fase III también se realizaron en la Argentina por la Fundación Huésped en los centros Vacunar, con la participación de 3.000 voluntarios”, se remarca.
Sputnik V
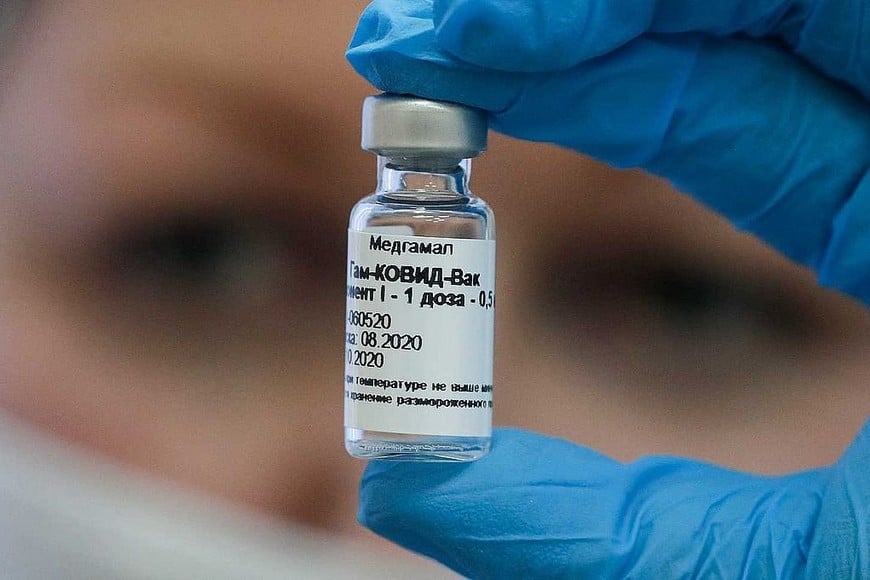
Sputnik V no posee ningún elemento del coronavirus en su composición, se presenta en forma liofilizada, es decir, como un polvo que se mezcla con un excipiente para disolverlo y luego administrarlo por vía intramuscular.
El fármaco utiliza una tecnología de adenovirus humano de dos vectores diferentes, Ad5 y Ad26, para una primera y una segunda inyección. Sin embargo, Sputnik V no contiene adenovirus humanos vivos, sino vectores adenovirales humanos que no son capaces de multiplicarse y son completamente seguros para la salud.
Los “vectores” son vehículos que pueden introducir material genético de otro virus en una célula. El gen del adenovirus, que es el causante de la infección, se sustrae y en su lugar se inserta un gen con el código de la proteína de otro virus. El elemento insertado es seguro para el organismo y ayuda al sistema inmunológico a reaccionar y producir anticuerpos que nos protegen de la infección.
La vacuna Sputnik V tiene un conjunto de características únicas que la convierten en una de las vacunas más competitivas del mundo. El pasado 14 de diciembre el Centro Gamaleya y RDIF anunciaron los resultados del análisis de los datos del tercer y último punto de control de los ensayos de Fase III, publicados en la revista científica The Lancet, y con datos a 21 días después de que los voluntarios recibieran la primera dosis de la vacuna.
La efectividad de la vacuna Sputnik V fue del 91,4%, dato que se confirmó en cada uno de los tres puntos de control de los ensayos clínicos. Asimismo, la eficacia de la vacuna Sputnik V contra casos graves de infección por coronavirus fue del 100%. Entre los casos confirmados de infección por coronavirus, se registraron 20 casos graves en el grupo de placebo, mientras que no se registraron casos graves en el grupo que recibió la vacuna.
Covishield
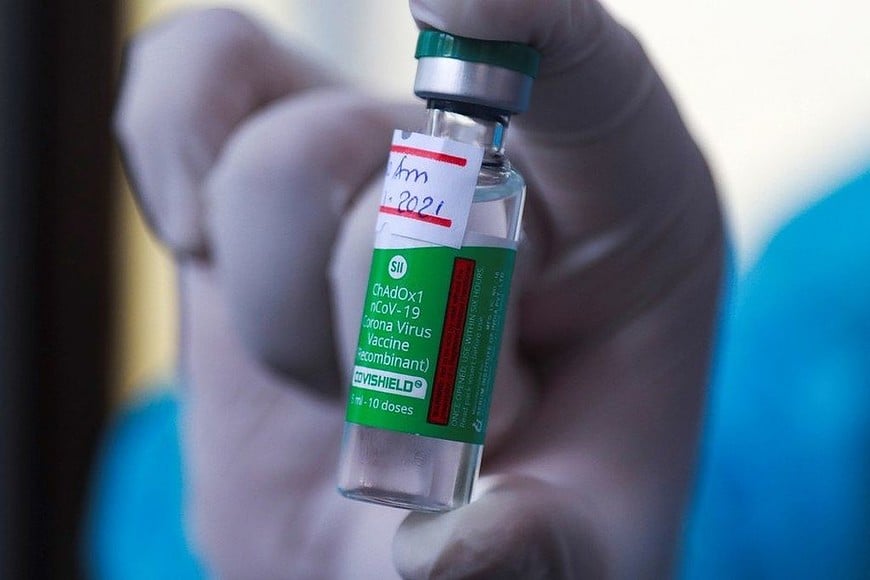
El 9 de febrero último, el Ministerio de Salud de la Nación habilitó el uso de emergencia de la vacuna Covishield fabricada en India, mientras que el Gobierno celebró un convenio con el Serum Institute de India, el organismo encargado de producirla en colaboración con la Universidad de Oxford y AstraZeneca, “en el contexto de una transferencia tecnológica”.
“Esta vacuna actualmente se presenta como una herramienta terapéutica segura y eficaz de acceso para que nuestro país baje la mortalidad, reduzca la morbilidad y disminuya la transmisibilidad de la enfermedad COVID-19 producida por el virus SARS-Cov-2″, justificó la cartera nacional sanitaria en la Resolución 627/2021, publicada en el Boletín Oficial.
La vacuna denominada “COVISHIELD/ ChAdOx1nCoV-19 Corona Virus Vaccine - Recombinant” la producen Oxford-AstraZeneca en el Serum Institute of India, el mayor fabricante de vacunas del mundo, que produce a razón de más de 50 millones de dosis al mes.
Está compuesta de una versión debilitada de un virus del resfriado común (conocido como adenovirus) de chimpancés y se ha modificado para que se parezca más al coronavirus, sin causar enfermedades. Como toda vacuna, cuando se la inyecta en el organismo, hace que el sistema inmunológico comience a producir anticuerpos y lo prepara para atacar cualquier infección por coronavirus. La misma se administra en dos dosis con entre cuatro y 12 semanas de diferencia.
Según su fabricante, se puede almacenar de manera segura a temperaturas de entre 2 °C y 8 °C, aproximadamente lo mismo que una heladera doméstica, y se puede administrar en entornos de atención médica existentes, como los consultorios médicos o farmacias, por lo que constituye una gran ventaja frente a competidores como la de Pfizer-BioNTech, que actualmente se administra en varios países, y debe almacenarse a -70 °C, moviéndose un número limitado de veces.
Los ensayos clínicos internacionales de la vacuna Oxford-AstraZeneca demostraron que cuando las personas recibieron media dosis y luego una dosis completa, la efectividad alcanzó el 90%. Pero no había suficientes datos claros para aprobar la idea de media dosis y dosis completa. Los fabricantes indios de la vacuna aseguran que Covishield es “altamente eficaz” y está respaldada por los ensayos de fase III realizados en Brasil y Reino Unido.
La vacuna producida en India y autorizada ya por 12 autoridades sanitarias en el mundo fue aprobada por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT), que contó “con toda la información según lo establecido por el procedimiento para la autorización de emergencia, en relación con el cumplimiento de los estándares requeridos de las plantas elaboradoras, el desarrollo y la elaboración de los productos, su certificación en el país de origen y el cumplimiento de los estándares de calidad”, según comunicaron las fuentes oficiales. Así, la Dirección Nacional de Control de Enfermedades Transmisibles ha elaborado un informe técnico en el que consideró “recomendable proseguir con la solicitud de autorización de emergencia de la misma”.

Además, “no se han presentado eventos adversos graves, ni se han identificado diferencias significativas en la eficacia observada en los diferentes grupos etarios que participaron de los ensayos clínicos”, subraya la resolución firmada por el entonces ministro Ginés González García. El Gobierno también celebró un convenio con el Serum Institute de India, para la transferencia tecnológica de la misma.
India es un gran productor de medicamentos y, también de vacunas con investigación propia. En agosto de 2020 constituyó un Grupo Nacional Experto para la Administración de la Vacuna contra el COVID-19 con el objetivo de coordinar la contratación y distribución de vacunas. A la fecha tiene avanzados tres proyectos: por un lado, Covaxin, desarrollada por Bharat Biotech en asociación con el Consejo Indio para la Investigación Médica (CMR, en inglés); en segundo lugar, ZyCOV-D, desarrollada por Zydus Cadila, que espera producir más de 100 millones de dosis; y por último, la Covishield, aprobada este martes por el Gobierno, que es un proyecto del Serum Institute of India en colaboración con AstraZeneca para desarrollar una investigación original de la Universidad de Oxford.
A pesar de que India inició recientemente su programa de inmunización local, con el objetivo de competir con China, ha estado abasteciendo a países vecinos con millones de dosis de la vacuna de AstraZeneca. Hasta ahora, India ha suministrado 15,6 millones de dosis de la vacuna a 17 países, ya sea a través de donaciones o contratos comerciales.